¿Que es la ley Combinada ?
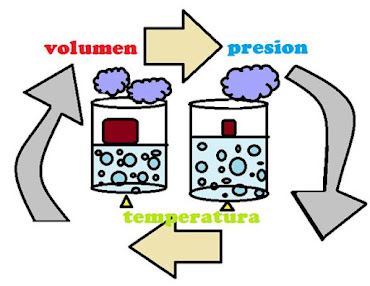
La ley combinada de los gases es aquella que unifica las leyes de Charles, la ley de Gay-Lussac y la ley de Boyle. En esta ley se relaciona las variables de presión, volumen y temperatura de una cantidad fija de un gas.
¡Veamos! algunos datos mas acerca de esta ley:
Donde:
- es la presión del gas,
- es el volumen del gas,
- es la temperatura del gas en Kelvin.
Esta combinación de leyes señala lo siguiente:
- La
presión es inversamente proporcional al volumen y directamente
proporcional a la temperatura.
- El
volumen es directamente proporcional a su temperatura.
Por lo tanto, la ley de los gases combinados, establece
claramente que:
La relación entre el producto presión-volumen y la
temperatura de un sistema permanece constante.
Veamos un ejemplo
A la temperatura de 25 ºC y a la presión de 690 mmHg, cierta
cantidad de oxígeno ocupa un volumen de 80 ml. ¿Cuál será el volumen ocupado
por el gas en condiciones normales?
Solución paso a paso
Analizamos el problema y lo que hacemos primero es reunir nuestros datos.
T1 = 25 ºC + 273 = 298 K
P1 = 690 mmHg
V1 = 80 ml
V2= ?
Sabiendo nuestra fórmula
Como nos están indicando que el gas que ocupa un recipiente, se encuentra en condiciones normales, los parámetros para la misma, es que la temperatura se encuentre a los 0 ºC = 273 K y la presión sea 760 mmHg = 1 atmósfera.
Entonces: P2 = 760 mmHg y T2 = 273 K
Despejamos V2 de la fórmula general y queda:
Finalmente, el volumen queda:
V2 = 66,54 ml, lo cual en litros sería: 0,067 litros.
Actividad
1. Problema 1: Un gas a O ºC y 600 mmHg de presión, tiene un
volumen de 500 ml. Si la presión es aumentada a 800 mmHg y el volumen varía a
600 ml. Determine la nueva temperatura expresada en grados Celsius.
R Rta:159.09°C
2. Problema 2: Un gas que ocupaba un volumen de 528 ml a la
presión de 745 mmHg y a la temperatura de 12 ºC, fue dejado expandirse hasta
que el volumen midió 890 ml a la temperatura de 30 ºC. ¿A qué presión estará
sometido el gas?
R Rta:672.32mmHg
3. Problema 3: Un gas a 20 °C20°C y 700 mmHg700mmHg de presión, tiene un volumen de 400 ml400ml. Si la presión es aumentada a 900 mmHg900mmHg y el volumen varía a 500 ml500ml. Determina la nueva temperatura expresada en grados Celsius.
R Rta:200.20°C
4 Problema 4:Un gas que ocupaba un volumen de 650 ml650ml a la presión de 800 mmHg800mmHg y a la temperatura de 25 °C25°C, fue dejado expandirse hasta que el volumen midió 950 ml950ml a la temperatura de 35 °C35°C. ¿A qué presión estará sometido el gas?
Rta: 597.61mmHg
Laboratorio para mostrar la ley:
Efecto de la temperatura en la presión de un gas en un recipiente cerrado"
Objetivo: Observar cómo la
presión de un gas en un recipiente cerrado cambia con la temperatura,
demostrando la relación de la Ley Combinada de los Gases.
Materiales necesarios:
·
Un cilindro graduado de vidrio o un recipiente
cerrado con un tapón ajustado
·
Un termómetro
·
Un manómetro (opcional, para medir la presión)
·
Agua caliente
·
Agua fría
·
Hielo
·
Un soporte para el cilindro
·
Un cronómetro o temporizador
Procedimiento:
1. Preparación
del sistema:
· Llena el cilindro graduado o el recipiente
cerrado con aire, asegurándote de que no haya fugas. Anota el volumen inicial
del gas (VV).
· Si es posible, conecta un manómetro al
recipiente para medir la presión.
2. Medición
de la presión inicial:
· Coloca el recipiente en un baño de agua fría
(puedes usar agua helada) y deja que se estabilice durante unos minutos.
· Mide y registra la temperatura del agua (T1T1)
y la presión del gas en el manómetro (P1P1).
3. Calentamiento
del gas:
· Retira el recipiente del agua fría y colócalo en
un baño de agua caliente. Asegúrate de que el agua caliente cubra el recipiente
adecuadamente.
· Mide y registra la nueva temperatura del agua (T2T2)
en el momento en que el sistema se estabiliza.
4. Medición
de la presión final:
· Observa y registra la nueva presión del gas en
el manómetro (P2P2) después de que el recipiente ha estado en el agua
caliente durante unos minutos.
5. Análisis
de resultados:
· Compara los valores iniciales y finales de
presión y temperatura.
· Discute cómo el aumento de temperatura afecta la
presión del gas en el recipiente cerrado, y cómo esto se relaciona con la Ley
Combinada de los Gases.
Conclusiones:
·
A medida que la temperatura del gas aumenta, la
presión también aumenta, lo que demuestra que la presión de un gas es
directamente proporcional a su temperatura cuando el volumen se mantiene
constante.
· Comprueba si el experimento cumple de manera práctica la
relación entre presión, temperatura y volumen de un gas, de acuerdo con la Ley
Combinada de los Gases.






No hay comentarios:
Publicar un comentario