LEY DE BOYLE
La ley de Boyle describe los cambios de volumen al variar la presión, cuando la temperatura es constante (T=cte)
La ecuación de Boyle es :
Dónde:
P
V
P
V
V1 V2
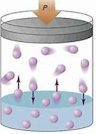
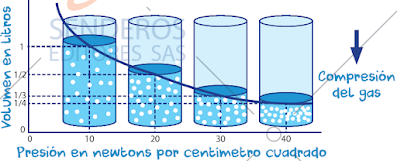
Segun la imagen a medida que la presión aumenta, el volumen del gas disminuye, Lo que indica que la presión y el volumen de un gas son inversamente proporcionales.
Problema 1.-
Una muestra de oxígeno ocupa 4.2 litros a 760 mm de Hg. ¿Cuál será el volumen
del oxígeno a 415 mm de Hg, si la temperatura permanece constante?
Solución paso a paso
Lo primero que vamos analizar para la resolución del problema, son nuestros datos, saber que tenemos y que nos hace falta.
Por lo que podemos observar el problema nos pide el volumen final es
decir P2=, vamos a
utilizar la fórmula de Boyle-Mariotte e iniciaremos a despejar la variable que
necesitamos para poder iniciar a resolver el problema.
P1V1=P2V2
Despejando >>
Sustituyendo nuestros datos.
Por lo que nuestro volumen final es de 7.69 litros.
Con esto podemos concluir que
mientras la presión bajó el volumen aumentó.
ACTIVIDAD
Problema 1. Un gas ocupa 1.5 litros a una presión de 2.5 atm. Si la temperatura permanece constante, ¿Cuál es la presión en mm de Hg, si se pasa a un recipiente de 3 litros?
Rta. 1.25 atm
Problema 2.Calcular el volumen de un gas a una temperatura constante al recibir una presión de 5 atm, si su volumen es de 3.4 litros a una presión de 2.5 atmósferas.
Rta. 1.7 Litros
Problema 3.Un gas a una temperatura constante ocupa un volumen de 600 cm³ a una presión de 760 mm de Hg, ¿cuál será su volumen si la presión recibida aumenta a 1500 mm de Hg?
Rta. Volumen final del gas es de 304 cm3
Problema 4.Un gas recibe una presión de 2 atmósferas y ocupa un volumen de 125 cm³, calcular la presión que debe soportar para que su volumen sea de 95 cm³.
Rta. 2.63 atm
Laboratorio para mostrar la ley
Compresión de un gas en
un cilindro"
Objetivo: Demostrar cómo el volumen de un gas disminuye a medida que la
presión aumenta en un recipiente cerrado.
Materiales necesarios:
·
Un cilindro o tubo de plástico
(transparente si es posible) con un émbolo (como un jeringa grande sin aguja)
·
Un manómetro (opcional, para
medir la presión)
·
Un soporte para sostener el
cilindro
·
Un termómetro (para asegurarse
de que la temperatura se mantenga constante)
·
Agua (opcional, para evitar que
el émbolo se mueva demasiado rápido)
Procedimiento:
1. Preparación del sistema:
·
Llena el cilindro o la jeringa
con aire, asegurándote de que no haya fugas. Anota el volumen inicial del gas
(V1V1). Si usas una jeringa, el volumen puede leerse directamente de
las marcas en la jeringa.
2. Medición de la presión inicial:
·
Si tienes un manómetro,
conéctalo al cilindro para medir la presión inicial del gas (P1P1). Si
no, puedes anotar la presión atmosférica como referencia.
3. Compresión del gas:
·
Presiona el émbolo (o el
extremo de la jeringa) lentamente para reducir el volumen del gas en el
cilindro. A medida que reduces el volumen, observa cómo cambia la lectura del
manómetro (o la presión).
·
Anota el nuevo volumen del gas
(V2V2) y la nueva presión del gas (P2P2) después de realizar la
compresión.
4. Repetir el proceso:
·
Puedes repetir el proceso
varias veces, cada vez presionando más el émbolo y anotando los nuevos valores
de volumen y presión.
5. Análisis de resultados:
·
Compara los valores de presión
y volumen que has registrado. Observa la relación inversa entre el volumen y la
presión del gas. Según la Ley de Boyle, si trazas un gráfico de PP contra VV,
deberías observar una relación inversa (una hipérbola).
Conclusiones:
·
A medida que el volumen del gas
disminuye al comprimirlo, la presión aumenta, lo que demuestra la Ley de
Boyle: P⋅V=constanteP⋅V=constante.
·
Este experimento es una forma
efectiva de observar el comportamiento de los gases en respuesta a cambios de
presión y volumen.





No hay comentarios:
Publicar un comentario